どうもこんにちは、だいさくです。
2021年の11月に臨床研究審査委員会(CRB)の内容が少しだけ改定されました。
その少しだけ改定されたという部分が実は結構重要だったりするので、
今日はその改定内容とそれによってどのような影響を受けそうなのか?というのを、
ご紹介させていただければと思います。
臨床研究審査委員会(CRB)認定要件が改定されたのでわかりやすくご紹介
今回ご紹介するCRBの認定要件に関する改定は、
2021年の11月に行われた、
厚労省の中にある厚生科学審議会臨床研究部会の中で話された内容なのですが、
そのほとんどは「継続して検討していく」という内容に留まっています。
例えば、臨床研究法の適用範囲だったり、その資金提供先の開示義務など、
その辺はまだ継続して議論していくとなっているんですが、
その部会の中で今回決定したことがあって、
それがCRBの認定施設要件に関する文言で、
”年間の委員会開催回数は11回から7回に緩和するものの、新規審議件数の要件を「年間2件を目安、最低年1件」と新たに設ける”
ん?どういう意味だ?と思いそうですが、
理解するのは全然簡単なのですが、
もしかしたらご自身のご担当先も入ってるかもしれませんし、
少なからず影響を受けますので、
かなりわかりやすく噛み砕いてご紹介できると思いますので是非ご一読ください。
臨床研究審査委員会(CRB)は臨床研究法で制定された

CRBは元々臨床研究法というのが2018年に制定されたのですが、
その中で議論されていたものの一つで、
今回の改定に関する部会の大枠のテーマは、
「臨床研究法制定5年後の見直しに関する検討案」の中で話されたものです。
ちなみに、ご存知かと思いますが、CRBはIRB(審査倫理委員会)では無いですので!
(役割はかなり似てますが)
こちら臨床研究法が制定された時に書いた記事なのですが、
【要チェック!】臨床研究法が見直されてる!これは注目しておいた方が良いぞ!
要はこの法律が制定されたことで、製薬会社が臨床研究に関与しづらくなったりもしましたが、
僕は今事業開発で治験なんかにも少し知識があるのですが、あんまり関係ないかもですね。。
むしろ無駄な資金提供しなくて良くなった分、
うちのような小さい会社で対象疾患が限られているような会社は、
多分にメリットの方が大きいかなって思います。
臨床研究法は、臨床研究の実施の手続であったり、
先に説明した認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、
臨床研究に関する資金等の提供に関する情報の公表の制度等を定めた法律になります。
下記の項に書いてますが、その中の一つにCRBがあります。
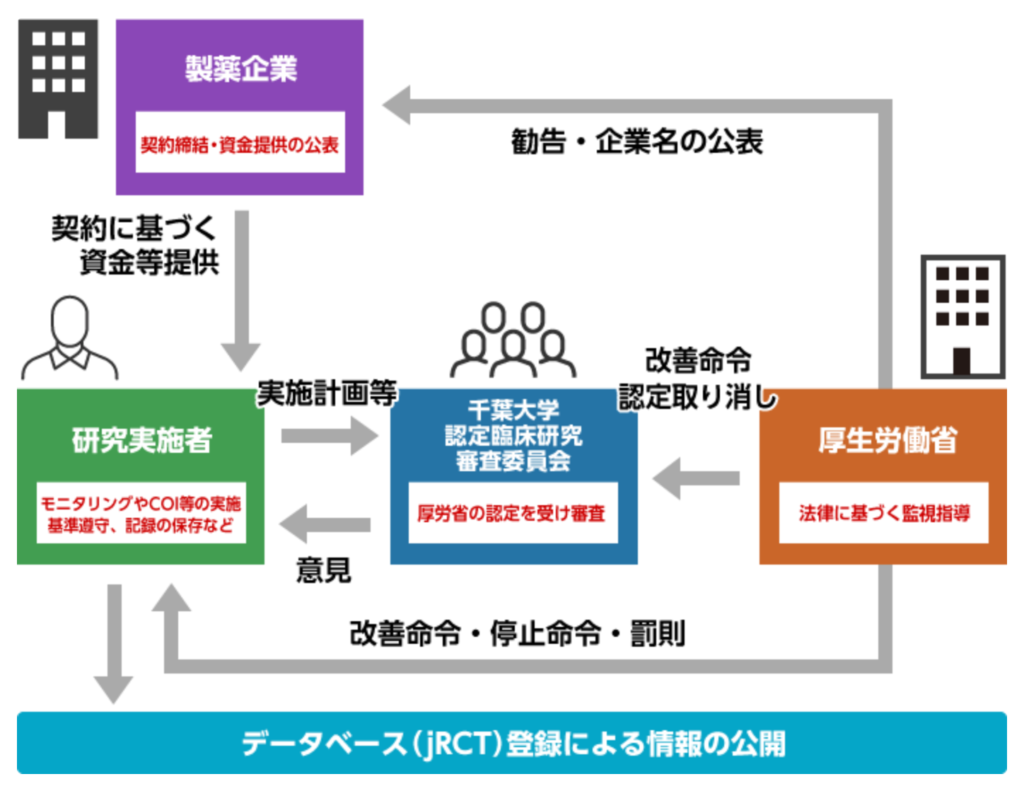
医療機関にとってCRBはどのような役割をしてるか?

その臨床研究法の中の第3章にCRBというのが設置されているのですが、
CRBの設置用件はこちらでまとめられていますが、
まぁ読まなくて全然良いと思います。
簡単にその設置する意味をお伝えすると、
臨床研究審査委員会というのは、
臨床試験に関する専門的な知識を持つ委員で構成されています。
(構成委員は自施設の人間が半数未満で構成されなければならない)
ですので、新しい治験薬に関して、
本当にその治験をその施設が行うべきかどうかを公正な審査ができる体制を整えていると言えます。
臨床研究法に基づいて特定臨床研究の実施計画を審査したり、
その研究者に義務付けられる副作用報告を受け、
必要に応じて原因究明や再発防止のための意見を述べたりする委員会になります。
わかりやすい図ないかなぁと思っていたんですが、千葉大のHPがわかりやすいです。
認定臨床研究審査委員会は全然開かれてない
このCRBの認定を受けている施設というのは現在61施設あって、
そのほとんどが大学病院で、あとは国立の専門機関、
民間病院で認定を受けているのは沖縄徳洲会のみになります。
臨床研究方が制定されて3年が過ぎましたが、
そのCRBの認定要件として、
臨床研究審査委員会を年間11件以上開催するというのがあるんですが、
まず11件自体をクリアしている施設が55%程度になっており、
40%強はCRBの認定を受けたもの全然やってませ〜んみたいなことになっています。
なので、ここは緩和され11件から7件に緩和されました。
ちなみに元々は4件に緩和される予定だったんですが、そんなの認定施設としてありえない!
という意見があり却下されました。
ただ、7件でもクリアしてない施設が25%程度あります。
新規件数をクリアできない施設も15%程度
そして7件に緩和する代わりに、新規治験の件数を年2件以上という文言が追加されました。
そしてその要件をクリアしてない施設が大体15%くらいありそうです。
現認定施設にとってどんな影響が?

例えば治験王国である国立がんセンターはどれくらいなのかなぁと思って見てみたら、
年間40件以上委員会が開催されています。
しかし、この新しい要件をクリアできそうにない施設が3〜4割くらい出そうで、
CRBの設置ってそもそも臨床研究中核病院の要件でもあったりするので、
該当施設には結構痛い改定だったりするわけです。
「おいおい、大学病院なのに全然高度な医療が提供できないじゃない」、
となれば患者も集まらなくなるし、医局運営にとっても死活問題だったりするわけです。
若手医師がここでは高度な先端医療は学べないとなってしまうし、
患者さんにとってもわざわざ遠方の専門施設に出向かなければならないわけです。
CRBを設定している施設というのは、国内に61機関あります。
主には大学病院や独立行政法人の専門施設がメインですが、
このうち3、4割は認定が外されてしまうかもです。
皆さんのご担当施設はございますでしょうか?
製薬会社にとってはデメリット?

臨床研究法の制定は製薬会社にとってメリットもデメリットもあったわけですが、
この結果を見ると、一見地方の大学病院なんて要件満たしてないんだから、
外してしまえよとか考えそうですが、
製薬会社の研究というのは当然多岐にわたっているし、
小児のウルトラオーファンのような分野は意外に地方の大学の1人の専門医が、
広範囲な知識を持っていたりすることもあったりします。
そんなところで治験ができなくなったりもするデメリットはあったりしますが、
でもやっぱ治験は集約できるに越したことはないので、
メリットの方があるのか・・
とりあえず、ご自身の担当先がもし認定を外されたら、
良いことは何も無いのかなと思います。
ではまた!



コメント