どうもこんにちは、だいさくです。
皆さんの会社からフィードバックがあったかもしれませんが、
厚労省のモニター制度の結果から、
今年からいわゆる覆面モニターが増員されるそうですよ。
ちなみに、今回の記事は全て噂ベースです。
ただ、それなりに確証のある噂ではあります。
なぜなら厚労省がモニター増やしますよ〜とかやっぱり言ってくれ無いので、
実際に会社の本社の方とお話ししていて、
厚労省に近い方が仰っていたので、
おそらくそうだろうというレベルの話ではありますので、
その辺ご了承のほど。
厚労省のモニター制度とは?
厚労省が行なっているモニター制度とは、大手製薬企業による、臨床研究データを不正に利用した広告が問題になった事例を受け「医療用医薬品の広告のあり方の見直しに関する提言」および、「臨床研究に関わる制度のあり方に関する報告書」において、医療用医薬品の広告の適正化のために、行政機関による監視・指導体制の強化を図ることが必要とされ、医療関係者による広告監視モニター制度が創設された。
とあります。
まぁディオバン事件がきっかけなんでしょうね。個人的にはディオバン事件って、
MRなんか悪い事したっけ?感はありますが、
MRを監視することによって製薬企業全体を監視するということなんでしょう。
こちらが概要図になります。
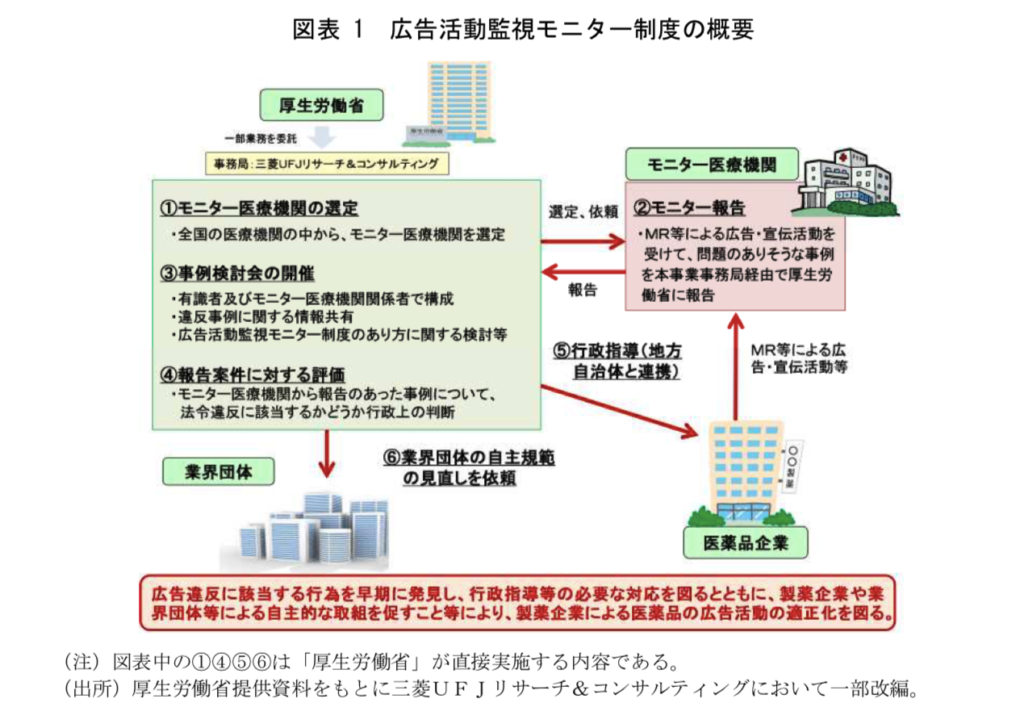
※こちらの監視モニター事業では、MRの活動の他にも学会での広告やコマーシャル上での疑義もモニターされております。
今までのモニター制度は基本プライマリー領域の監視

平成26年11月にモニター制度の概要がまとめられて、
平成27年から開始されています。
上記の概要図にもありますように、
厚労省が定めた医療機関の医師、薬剤師にモニターとなってもらい、
MRの情報提供が適切だったか?不適切だった場合に報告をしてもらうというのが、
簡単な流れになります。
これまでは監視の対象は主にはプライマリー領域だったとのことです。
プライマリー領域でも色々あると思いますし、
その中でもどこの領域が重点的に監視されていたのかはわからないですが、
創設の理由がディオバン事件であったのであればそれなりに納得はできます。
平成29年度は不適切な報告は23製品30件
平成29年度の結果(最新版)はどのような結果だったかと申し上げますと、
のべ23製品について適切性に関する疑義報告があり、
違反が疑われる項目はのべ30件ありました。
事実誤認の恐れのある表現が9件が一番多く、全体の39.1%でした。
疑義報告が行われた情報の入手方法としては、「企業の説明会」でこれも39.1%でした。
具体的な違反例
具体的な違反例は、こちらのPDFの14ページから記載されています。
普通に起こってしまうような事例が並べられています。
例えば、
「自社品との非劣勢の試験しか行われていないにも関わらず、他の同効薬とも比較したかのような「既存の同効薬と比べて」という表現でMRが説明した」
「医局での説明会において、妊婦又は妊娠している可能性のある婦人は禁忌であるにも関わらず、「若い女性にも使いやすい」とのプロモーションがあった。又、使用前に行うこととされている妊娠検査に関する情報提供はなかった」
「講演会において、比較を行うことが適切でないデータを並べて、同効薬農地特定の薬剤の副作用が多いとする公演が行われた。さらにその要因として、演者自身も不適切であることを承知しているはずの論理を用いて考察していた」
どうですかね。なんか普通に起こりそうですよね。
医療機関側も少し考えてほしい

今回のことではないんですが、過去にこんな事例もあったそうです。
医薬品の薬局への申請書の中に、「他剤との比較」を書く項があって、
自社医薬品は他剤との比較がされてない薬だが、参考データということで、
暫定的に使われる事がある他剤の添付文書の副作用のデータを並べて書いておいたら、
モニターから比較されてない副作用を比較したと指摘されたそうです。
これって、この申請書にそもそもそんな事を書く項を設けないでほしいと思うし、
オーファンの薬でもよくあることで、
標準治療がないから単アームのPhasellだけで承認ってこともあると思うんですよね。
でも「なんでも良いから書いておいてほしい」という薬局さんもあるんですよ。
だからそのように書いたのに無残にもモニターから指摘されるってどうなのかなと。
そもそも新薬の薬局への申請書は薬局側が書いたら良いのでは?と思ってしまう。
でもお忙しい薬剤師さんの代わりに書いたりしてる事を、
そのように言われるのは結構辛いと思う一方で、
医療機関側ももう少しルールをはっきりしてほしいなと思います。
違反例に対してExcuseができない

MR的な立場で言うと、「そんなことを言うつもりなんて全然なかった」って思いませんかね?
多分そんなつもりで言ったんじゃないんじゃないかなって思うようなこともあります。
でもこのモニターからの指摘に対して、
製薬企業側からは言い訳が許されていません。
内々では出来るのかもしれないけど、
基本的にモニターが誰かも知らされることはないので、
「こう言った事例が御社でありましたよ」で終わってしまいます。
そこにExcuseができないのです。
つい言ってしまった、も許されないんだと思います。
ちなみにですが報告のほとんどは薬剤師からだと言う噂です。
確かに医師が製薬企業のプロモーションルールを細かく把握してるとは思えないし、
大学の薬剤師からの報告が多いと言う噂です。(あくまで)
厚労省の覆面モニターが増員!次はスペシャリティとMSLが対象っぽい・・
今年からこのモニター制度の監視下にMSLも対象になったのは、
こちらの記事でも書きました。
【超重要!】製薬会社MR活動のガイドライン改定を分かりやすく解説してみる
今までは上述の通り、プライマリー領域への薬剤師からの監視が多かったようです。
しかし、今年はオンコロジーMRなどのスペシャリティ系や、
MSLへの活動にも監視の目が行きます。
僕の勝手な予想ですが、
どうしても医師はモニターとなったとしても、
そこまでルールを細かく把握してるように感じないので、
薬剤師からの報告が多くなってくると考えると、
MSLへの指摘はそこまで多くないのでは?と思ってしまいます。
ただやっぱりオンコロジーなどもしっかり気をつけたほうが良いと思います。
これは本当にふんどし締めたほうが良いと思います。
なんせExcuseできないので。。



コメント